محتويات
١ مقدمة
الذرة هي أصغر حجر بناءٍ أو أصغر جزء من العنصر الكيميائي يمكن الوصول إليه والذي يحتفظ بالخصائص الكيميائية لذلك العنصر.يرجع أصل الكلمة الإنجليزية (بالإنجليزية: Atom) إلى الكلمة الإغريقية أتوموس، والتي تعني غير القابل للانقسام؛ إذ كان يعتقد أنه ليس ثمة ما هو أصغر من الذرة.
تتكون الذرة من سحابة من الشحنات السالبة (الإلكترونات) التي تدور حول نواة موجبة الشحنة صغيرة جدًا في المركز، وتتكون النواة من بروتونات موجبة الشحنة، ونيوترونات متعادلة، وتعدّ الذرة هي أصغر جزء من العنصر يمكن أن يتميز به عن بقية العناصر؛
٢ النظرية الذرية:
الرمز النمطي للذرة. النظرية الذرية تهتم بدراسة طبيعة المادة، وتنص على أن كل المواد تتكون من ذرات./-الاكتشافات اليونانية في عام 430 ق.م توصل الفيلسوف اليونانى (ديموقريطس) إلى مفهوم أو فكرة في كل الأشياء مصنوعة من ذرات أو بالمعنى الحرفى كل الأشياء مكونة من ذرات غير قابلة للانقسام./واعتقد هذا الفيلسوف أن كل الذرات متماثلة وصلبة وغير قابلة للانضغاط إلى جانب أنها غير قابلة للإنقسام ، وأن الذرات تتحرك بأعداد لا حصر لها في فضاء فارغ.وأن الاختلاف في الشكل والحجم الذرى يحدد الخصائص المختلفة لكل مادة./وطبقاً لفلسفة (ديموقريطس) فإن الذرات ليست المكون الأساسي للمواد فقط ولكنها تكون أيضاً خصائص النفس الإنسانية./فعلى سبيل المثال فإن الآلام تسببها "الذرات الشريرة" وذلك لأن هذه الذرات تكون على شكل (إبر) بينما يتكون اللون الفاتح من الذرات المسطحة ذات الملمس الناعم ، وقد اعتقد ديمقريطس واعتقد معه الناس أفكار هي بلا شك تثير تهكمنا الآن ولكنها كانت منذ قرون "العلم الذي لا يبارى"./إن النظرية اليونانية عن الذرة لها مدلول تاريخي وفلسفى بالغ الأهمية ، إلا أنها ليست ذات قيمة علمية، ذلك أنها لم تقم على أساس ملاحظة الطبيعة أو القياس أو الاختبارات أو التجارب. نموذج دالتون عدل وجاءت نظرية دالتون بشكل مختلف عما سبق ذلك كونها تعتمد على قوانين بقاء الكتلة والنسب الثابتة والتي اشتقت من العديد من الاستنتاجات المباشرة. يمكن التعبير عن النظرية التي اقترحها بالاتي :/ الأشياء (المواد) تتكون من العديد من الجسيمات الغير قابلة للتجزئة (ذرات) ذات حجم صغير جداً. ذرات نفس العنصر متشابهة في الخواص (الشكل ، الحجم ، الكتلة)، وتختلف تماماً عن ذرات العناصر الأخرى. الذرة مصمتة متناهية الصغر،غير قابلة للتجزئة يمكن لذرات العناصر المختلفة أن تتحد مع بعضها بنسب عددية بسيطة مكونة المواد. الاتحاد الكيميائي عبارة عن تغيير في توزيع الذرات. وعندما سأل دالتون عن شكل الذرة قال إنها دائرية الشكل ومضغوطة بحيث لايستطيع أي شي اختراقها. لقد أثبتت نظرية دالتون نجاحها من خلال تفسيرها لبعض الحقائق القائمة في ذلك الزمان كما أنها استطاعت أيضا التنبؤ ببعض القوانين الغير مكتشفة :/ تفسر هذه النظرية (قانون النسب الثابتة) :/ افترض دالتون ان مادة ما تتكون من عنصرين A و B./وان أي جزيئي من هذه المادة يتكون من ذرة واحدة من A وذرة واحدة من B يعرف الجزيء بأنه مجموعة ذرات مترابطة مع بعضها بقوة تسمح لها بالتصرف أو اعادة التنظيم كجسيم واحد./افترض أيضا ان كتلة الذرة A تكون ضعف كتلة الذرة B وبالتالى فان الذرة A تساهم بضعف الكتلة التي تساهم بها الذرة B في تكوين جزيء واحد من هذه المادة الأمر الذي يعني ان نسبة كتلة الذرة Aالى الذرة B هي 2/1./في مركب الماء نسبة الهيدروجين إلى الأكسجين دائماً ثابتة :/ 2,00g H /16,00g O=1,00g H / 8,00g O لقد تنبأت نظرية دالتون بقانون النسب المتضاعفة (قانون النسب المتعددة):/ عندما تتحدد ذرة ما مع أخرى وتشكل أكثر من مركب فإن نسبة الأوزان لتلك الذرة التي تتحد مع واحد جرام من الذرة الأخرى يجب أن يكون نسبة بسيطة.٣ ميكانيكا الكم للتركيب الإلكتروني للذرة:
تتكون الذرة من سحابة من الشحنات السالبة (الإلكترونات) تحوم حول نواة موجبة الشحنة صغيرة جدا في المركز./تتكون النواة الموجبة من بروتونات موجبة الشحنة، ونيوترونات متعادلة./الذرة هي أصغر جزء من العنصر يمكن أن يتميز به عن بقية العناصر؛ إذ كلما غصنا أكثر في المادة لنلاقي البنى الأصغر لن يعود هناك فرق بين عنصر وآخر./فمثلاً، لا فرق بين بروتون في ذرة حديد وبروتون آخر في ذرة يورانيوم مثلاً، أو ذرة أي عنصر آخر./الذرة، بما تحمله من خصائص؛ عدد بروتوناتها، كتلتها، توزيعها الإلكتروني...، تحدد الفروق بين خصائص العناصر المختلفة، وكذلك تحديد قابلية عنصر ما لدخول تفاعل كيميائي من عدمه، أما بالنسبة لتساوي عدد البروتونات في أنوية واختلاف أعداد النيوترونات فهو مايسمي بنظائر العنصر الواحد./ظل تركيب الذرة وما يجري في هذا العالم البالغ الصغر، ظل وما زال يشغل العلماء ويدفعهم إلى اكتشاف المزيد./ومن هنا أخذت تظهر فروع جديدة في العلم حاملة معها مبادئها ونظرياتها الخاصة بها، بدءاً من مبدأ عدم التأكد، مروراً بنظريات التوحيد الكبرى، وانتهاءً بنظرية الأوتار الفائقة./أكثر النظريات التي لاقت قبولا لتفسير تركيب الذرة هي النظرية الموجية./وهذا التصور مبني على تصور نيلز بور مع الأخذ في الاعتبار الاكتشافات الحديثة والتطويرات في ميكانيكا الكم./و التي تنص على :/ تتكون الذرة من جسيمات تحت ذرية (البروتونات ،الإلكترونات ،النيوترونات). مع العلم بأن معظم حجم الذرة يحتوى على فراغ. في مركز الذرة توجد نواة موجبة الشحنة تتكون من البروتونات ،النيوترونات (ويعرفوا على أنهم نويات) النواة أصغر 100،000 مرة من الذرة./فلو أننا تخيلنا أن الذرة بإتساع مطار هيثرو فإن النواة ستكون في حجم كرة الجولف في عام 1926م وضع العالم النمساوي ارفين شرودنجر معادلته الموجية التي تحمل اسمه، وعندما تم تطبيق المعادلة على ذرة الهيدروجين تبين أن حركة الالكترون حول النواه تشبه السحابه واستبدل شرودنجر مفهوم المدار الإلكتروني بالأوربيتال ليتم وضع نموذج أكثر موضوعية للتركيب الإلكتروني للذرة:/ معظم الفراغ الذري يتم شغله بالأوربيتالات التي تحتوى على الإلكترونات في شكل إلكترونى محدد. كل أوربيتال يتسع لعدد 2 إلكترون ، محكومين بثلاث أرقام كمية:/ عدد الكم الرئيسي و عدد الكم الثانوي و عدد الكم المغناطيسي. كل إلكترون في أي من الأوربيتالات له قيمة واحدة لعدد الكم الرابع والذي يسمى عدد الكم المغزلي. الأوربيتالات ليست ثابتة ومحددة في الاتجاه وإنما هي تمثل إحتمالية تواجد 2 إلكترون لهم نفس الثلاث أعداد الكمية الأولى، وتكون آخر حدود هذا الأوربيتال هي المناطق التي يقل تواجد الإلكترون فيها عن 90%. تميل الإلكترونات إلى أن تشغل أقل مستويات الطاقة في الذرة ، والذي تكون المدارات فيه قريبة للنواة (مستوى الطاقة الأول)./وتكون الإلكترونات الموجودة في المدارات الخارجية (مدار التكافؤ) هي المسئولة عن الروابط الكيميائية المختلفة بين الذرات..../لمزيد من التفاصيل راجع التكافؤ والترابط٤ الإنشطار النووي:
كان إنريكو فيرمي أول من قام بتصويب النيوترونات على اليورانيوم عام 1934 ولكنه لم ينجح في تفسير النتائج./وقام العالم الكيميائي الألماني أوتو هان وزميلته ليز مايتنر وزميلهما شتراسمان بتلك الأبحاث وقاموا بتحليل المواد الناتجة عن التفاعل./وكانت مفاجأة لم يستطيعوا أولا تفسيرها إذ أنهم وجدوا عناصر جديدة تكونت من خلال التفاعل./وكان أن أعادوا التجربة باستخدام يورانيوم عالي النقاء، فكانت النتيجة هي ما وجدوه من قبل وتكوّن عنصر الباريوم، والباريوم عدده الذري تقريباً نصف العدد الذري لليورانيوم./كان ذلك عام 1938 وبعدها بدأت الحرب العالمية الثانية واضطرت ليزا مايتنر مغادرة ألمانيا نظرا لاضطهاد النازية لليهود./وسافرت ليزا إلى السويد حيث كان أحد أقربائها يعمل هناك وهو روبرت فريتش./وقصت عليه نتائج تجربة اليورانيوم. وفي مطلع عام 1939 فطن العالم أتوهان وشتراسمان إلى تفسير التفاعل الذي حدث وانه انشطار لنواة ذرة اليورانيوم وتكون الباريوم ونشر نتيجة ابحاثه في المجلة العلمية./وفي نفس الوقت استطاعت مايتنر بمساعدة فريتش على تفسير تجربة اليورانيوم بأنها انشطار نووي ن واستطاعا الاثنان تكملة التفسير بأنه من خلال إنقسام نواة اليورانيوم يحدث فقدا في الكتلة بين كتلة اليورانيوم وكتلتي الباريوم والكريبتون الناتجة عن الانقسام، وقدرا تلك الكتلة المفقودة بأنها نحو 1/5 من كتلة البروتون، أي أن طاقة تقدر بنحو 200 MeV تتحرر من كل انقسام./وهي طاقة بالغة للغاية./وسافرا الأثنان بعد ذلك إلى الولايات المتحدة واجتمعا مع أينشتاين وقصا عليه نتيجة أبحاثهما. وكانت مجموعة من العلماء تعمل في فرنسا تحت رئاسة فريدريك كوري زوج ماري كوري- مكتشفة البولونيوم - واكتشفوا أنه خلال انشطار نواة اليورانيوم ينطلق عدد من النيوترونات قدروه 3,5 في المتوسط إلا أنهم عدّلوا ذلك العدد إلى 2,6 نيوترونات في المتوسط لكل انشطار فيما بعد. ولما عرف أينشتاين وزميله زيلارد بأمريكا نتائج مايتنر وفريتش بالإضافة إلي نتائج المجموعة الفرنسية عن النيوترونات المصاحبة للانشطار قام أينشتاين وزيلارد بتوجيه خطابا إلى الرئيس الأمريكي آنذاك روزفيلت يعرفوه بتلك النتائج العلمية الخطيرة والتحذير من إمكانية سعي الألمان باستغلال تلك المعلومات لصنع قنبلة ذرية يكون لها مفعولا فظيعا، خصوصا وأن الحرب قد بدأت في أوروبا بهجوم الألمان على بولندا./ووصل خطاب أينشتاين وزيلاد إلى الرئيس الأمريكي في يناير 1939.٥ مكونات الذرة:
الجسيمات ما تحت الذرية عدل على الرغم من أن كلمة ATOM تدل أصلا على الأجزاء التي لا يمكن أن تنقسم إلى أجزاء أصغر ، ولكن إكتشفت التجارب العملية أن الذرة تتكون من جسيمات تحت ذرية مختلفة./الجسيمات المكونة للذرة هي الإلكترون ، والبروتون والنيوترون، الإلكترون هو أقل كتلة من البروتون والنيوترون بكثير حيث تبلغ كتلته 9،11 × 10−31 كجم ، مع شحنة أولية (سالبة) تساوي 1,6 × 10−19 كولوم، بروتونات، ونيوترونات التي تتكون بدورها من الكواركات التي تعد أصغر جزء من المادة،عدد البورتونات في نواة الذرة يطلق عليه العدد الذري، ويحدد أي عنصر له هذه الذرة./فمثلاً النواة التي بها بروتون واحد (أي النواة الوحيدة التي يمكن أن لا يكون بها نيوترونات) من مكونات ذرة الهيدروجين، والتي بها 6 بروتونات، ترجع للعنصر كربون، أو التي بها 8 بروتونات أكسجين./يحدد عدد النيورتونات نظائر العنصر./عدد النيوترونات والبروتونات متناسب، وفي النويات الصغيرة يكونا تقريبا متساويين، بينما يكون في النويات الثقيلة عدد كبير من النيوترونات./والرقمان معا يحددا النيوكليد (أحد أنواع النويات)./البروتونات والنيوترونات لهما تقريبا نفس الكتلة، ويكون عدد الكتلة مساويا لمجموعهما معا، والذي يساوي تقريبا الكتلة الذرية./وكتلة الإلكترونات صغيرة بالمقارنة بكتلة النواة. نصف قطر النوكليون (نيترون أو بروتون) يساوي 1 Fm (فيمتو متر = 10−15 متر)./بينما نصف قطر النواة، والذي يمكن أن يكون تقريبا الجذر التربيعي لعدد الكتلة مضروبا في 1,2 fm، أقل من 0,01% من قطر الذرة./وعلى هذا تكون كثافة النواة أكثر من تريليون مرة (1012) من الذرة ككل./ويكون لواحد مللي متر مكعب من مادة النواة، كما لو كانت فيه كتلة 200،000 طن./النجم النيتروني يتكون من مثل هذا التصور. وبالرغم من أن البروتونات الموجبة الشحنة يحدث بينها وبين بعضها تضاد كهرمغناطيسي، فإن المسافة بين النيوكلونات تكون صغيرة بدرجة كافية لأن يكون التجاذب القوي (والذي تكون أقوى من القوى الكهرمغناطيسية ولكن تقل بشدة مع بعد المسافة) غالب عليها./(وتكون قوى الجاذبية مهملة، لكونها أضعف (1036) من القوة الكهرومغناطيسية).٦ الذرات في الكون والكرة الأرضية:
باستخدام نظرية التضخم الكوني، فإن عدد الذرات في الكون يتراوح من 4×1078 إلى 6×1079 تقريبا./وبصفة عامة نظرا لأن الكون لا نهائي فإن عدد الذرات أيضا يمكن أن يكون لا نهائي./وهذا لا يتنافى مع العدد الذي تم حسابه نظرا لأن الكون الخاضع للدراسة يقع ضمن 14 مليار سنة ضوئية.٧ الجزيئات :
الجزيء في الكيمياء هو أصغر وحدة من المادة الكيميائية النقية يحتفظ بتركيبها الكيميائي وخواصها. وعلم دراسة الجزيئات يختص به علم الكيمياء عموماً كما يوجد فرع لدراسة خواص الجزيئات فيزيائياً يسمى فيزياء جزيئية./وتهتم الكيمياء الجزيئية بالقوانين التي تحكم التفاعلات بين الجزيئات (التفاعلات الكيميائية واصطدام بعضها ببعض )./وينتج عن تلك التصادمات والتفاعلات تكوّن جزيئات أكبر (مركبات) أو يحدث تكسير للروابط الكيميائية وانفصال جزيء إلى جزيئات أصغر./و تهتم الفيزياء الجزيئية بالقوانين التي تحكم بناء الجزيئات وكذلك القوانين التي تتحكم في اصتدام الجزيئات ببعضها البعض ،٨ الرابطة الكيميائية :
في الجزيئات تكون الذرات بأزواج الإلكترونات المشتركة في "الرابطة الكيميائية"./وقد تتكون من ذرات لنفس العنصر الكيميائي, مثل الأكسجين (O2)، أو من ذرات عناصر مختلفة مثل الماء (H2O).٩ هندسة الجزيء:
الجزيئات لها حالة تعادل ثابتة بطول رابطة وزاوية بين الروابط معينين./وتتكون المادة النقية من جزيئات لها نفس البناء الفراغي./ويكون المعادلة الكيميائية وبناء الجزيء دور هام في تحديد خواص الجزيء, وخاصة نشاطيته./الأيزومرات تتشارك في نفس شكل المعادلة الكيميائية, ولكن يكون لكل منها خواص مختلفة تماما نظرا لاختلاف بنائها./الأيزومرات الفراغية، نوع خاص من الأيزومرات, ويمكن أن يكون لها خواص فيزوكيميائية متشابهه ولكن في نفس الوقت تختلف تماما في نشاطها الحيوي.٪ الطيف الجزيئي:
الطيف الجزيئي هو دراسة استجابة جزيء للطيف الذي له تردد معين (أو طبقا لمعادلة بلانك لطاقة ذلك الطيف)./وهذا الطيف عبارة عن موجة كهرومغناطيسية أو شعاع من الإلكترونات./وهناك تطوير في الأنواع الجديدة من المطياف الجزيئي ليصبح مطياف بوزيترون./ويمكن أن يكون الرنين الجزيئي ناتج من امتصاص الطيف (مطياف الامتصاص)، أو انبعاث طيف آخر (مطياف الانبعاث)، أو كنتيجة لتفتت الجزيء، أو تغير في حالته الكيميائية. ويعتبر المطياف أفضل الأدوات في التحقق من الخواص المجهرية للجزيئات، وبالتحديد، مستويات الطاقة./ومن أجل الحصول على أقصى المعلومات المجهرية من نتائج التجارب، فإنه يتم إقرآن الدراسات الطيفية مع دراسات الكيمياء الحسابية./كما أنه من المفيد معرفة أن الأصل النظرى للمطياف يرجع إلى نظرية التشتت.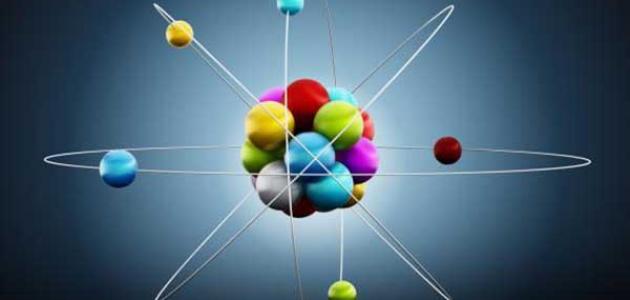

























.jpeg)